【シリーズ 未来の食】 第7回 培養肉の認可に必要なプロセスは?各国で異なる法規制と申請の流れ

【シリーズ 未来の食】
最終更新日:2024.10.01
第1回 世界で広がりを見せる代替プロテイン、どんな技術や製品がある?
第2回 代替プロテインはなぜ必要?社会に与えるインパクトを解説
第3回 代替プロテイン業界の歩み、誕生から現在に至るまで
第4回 植物性食品 〜日本の家庭でも身近な健康食〜
第5回 細胞培養 〜エシカル&サステナブルな肉を生み出す新技術〜
第6回 培養肉の製品化に向けて、クリアしなければならない課題は?
第7回 培養肉の認可に必要なプロセスは?各国で異なる法規制と申請の流れ
第8回 微生物発酵 〜菌のはたらきを活用する生産手法を深掘り〜
第9回 その他の技術開発動向について(分子農業、昆虫食ほか)
2020年のシンガポール以降、培養肉の安全性を認める国は増加し、普及に向けての下地が徐々に整ってきました。ですが、培養肉の受容に消極的な人々の間では、その安全性について疑問視する向きもあります。
では、これまでになかった新しい食品としての培養肉の安全性は、どのようにして担保されるのでしょうか?今回は、主要な市場として米国、欧州連合(EU)、そして日本における法規制の枠組みと認可プロセスを取り上げます。
🇺🇸 米国
米国で食品の安全基準やラベル表示といった規制を行う機関には、米国農務省(USDA)と米国食品医薬品局(FDA)の2つがあり、それぞれが複雑に監督権限を保有しています。
大まかにいうと、USDAは食肉(加工品を含む)と卵製品、FDAはその他の食品全般と管轄が分けられていますが、培養肉についてはどちらの機関がどのような権限を有するのか不透明な状況が、当初は続いていました。
こうした中、北米食肉協会(NAMI)と、NAMIの会員企業であるカーギルやタイソン・フーズから出資を受けていたMemphis Meats(現:UPSIDE Foods)が、2018年8月に当時のトランプ大統領に宛てた共同書簡を送り、培養肉についての明確な法整備を訴えます。その中では、市販前の安全面に関する検証をFDAが行い、生産・販売については従来の食肉と同様にUSDAが行うという分担制が提案されました。
その後公聴会などでの意見交換を経て、両当局は2019年3月に培養肉の規制を共同で管轄する体制を正式に示し、それぞれの役割分担を明確にした協定を発表。
FDAが企業との事前協議の窓口となるほか、生産においては細胞の採取から培養までの過程を監督し、増殖した細胞を収穫する段階でUSDAの食品安全検査局(USDA-FSIS)に担当が引き継がれることとなりました(下図参照)。
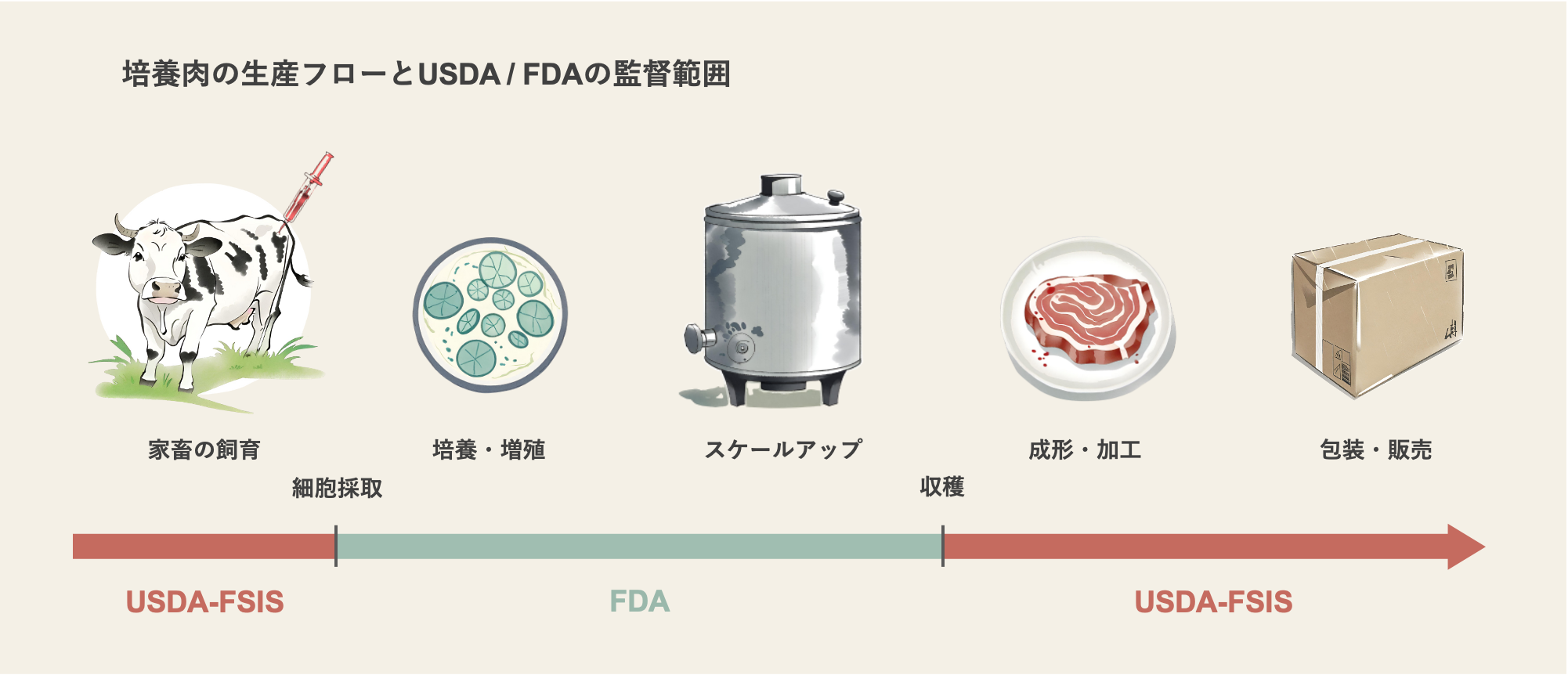
なお、魚介類については原則FDAの担当のため、培養シーフードはFDAが単独で管轄することとなっています。
上記の役割分担を踏まえて、培養肉製品を市場に出すために企業側が必要なステップは、次のとおり。
① FDAの安全性審査を通過し、「異議なし(No questions)レター」を取得
② USDA-FSISから製品の「表示認証(mark of inspection)」を取得
③ USDA-FSISから生産施設の「検査証明書(grant of inspection)」を取得
* ②と③は順不同
以上のプロセスを経て、初めて米国内での販売が認められます。昨年GOOD Meat、UPSIDE Foodsの2社に立て続けに認可が与えられたことで、今後の認可が下りるまでの期間に短縮が見られるかもしれません。
米国で行われた消費者調査(上記2社の認可前に実施)では、63%が「USDA/FDAに認可された場合、培養肉は安全だと思う」と回答しており、規制機関に対する信頼度の高さが表れています。
🇪🇺 欧州連合(EU)
EUでは、培養肉の販売には「新規食品(Novel Food)」の認可が必要となります。現行の関連食品規則は、2015年11月25日に制定、2018年1月1日に施行された「Regulation (EU) 2015/2283」。
新規食品とは、1997年5月15日以前にEU内で相当量が使用されていなかった食品や食品原料を指すもの。これまでに認可された例としては、新しい栄養素(ビタミンKの新しい供給源となったメナキノン=ビタミンK2)、既存の食品からの新しい抽出・分離物(ナンキョクオキアミから抽出したクリルオイル、牛乳から分離したラクトフェリン、コオロギパウダー)、第三国から輸入された農産物(チアシード、ノニ果汁)、新しい生産工程による食品(紫外線処理したパンや牛乳)などが挙げられます。
申請にあたっては、製造工程、組成情報、栄養素、毒性、吸収・代謝に関するデータ、その他の分析結果や研究データなどの提出が必要。
また、遺伝⼦組み換え技術を使⽤している場合には、遺伝⼦組み換え食品に係る規制「Regulation (EC) 1829/2003」が併せて適⽤されます。
認可プロセスは、次の各段階を経て完了という流れ。
① 欧州委員会(EC)が申請書類の有効性確認(1カ月以内)
② 欧州食品安全機関(EFSA)による安全性リスク評価(9カ月以内、追加書類が必要なら延長も)
③ ECによる認可判断、具体的な表示要件など検討(7カ月以内)
④ 専門委員会での審議(6〜18カ月程度)
②のEFSAによる安全性評価は省略される場合もありますが、最短でも半年程度、長いと3年近くを要します。
食品安全を守る規制当局のEFSAによる包括的なリスク評価と、EU全加盟国の代表者からなる専門委員会の最終承認が必要となるため、これだけ長くなっているようです。
また、個々の企業が申請前に規制当局と協議を行うことが認められておらず、何を求められているのか正確に理解することができないという難点も。新規食品の申請は「ブラックボックス」のようなものといわれており、スタートアップ企業にとってはかなりの難関です。
このため、欧州企業であっても、はじめの展開先に米国やシンガポールを選ぶ企業が多くなっていますが、欧州でひとたび承認された食品に関しては、十分な安全性の検証が行われているといえるでしょう。
🇯🇵 日本
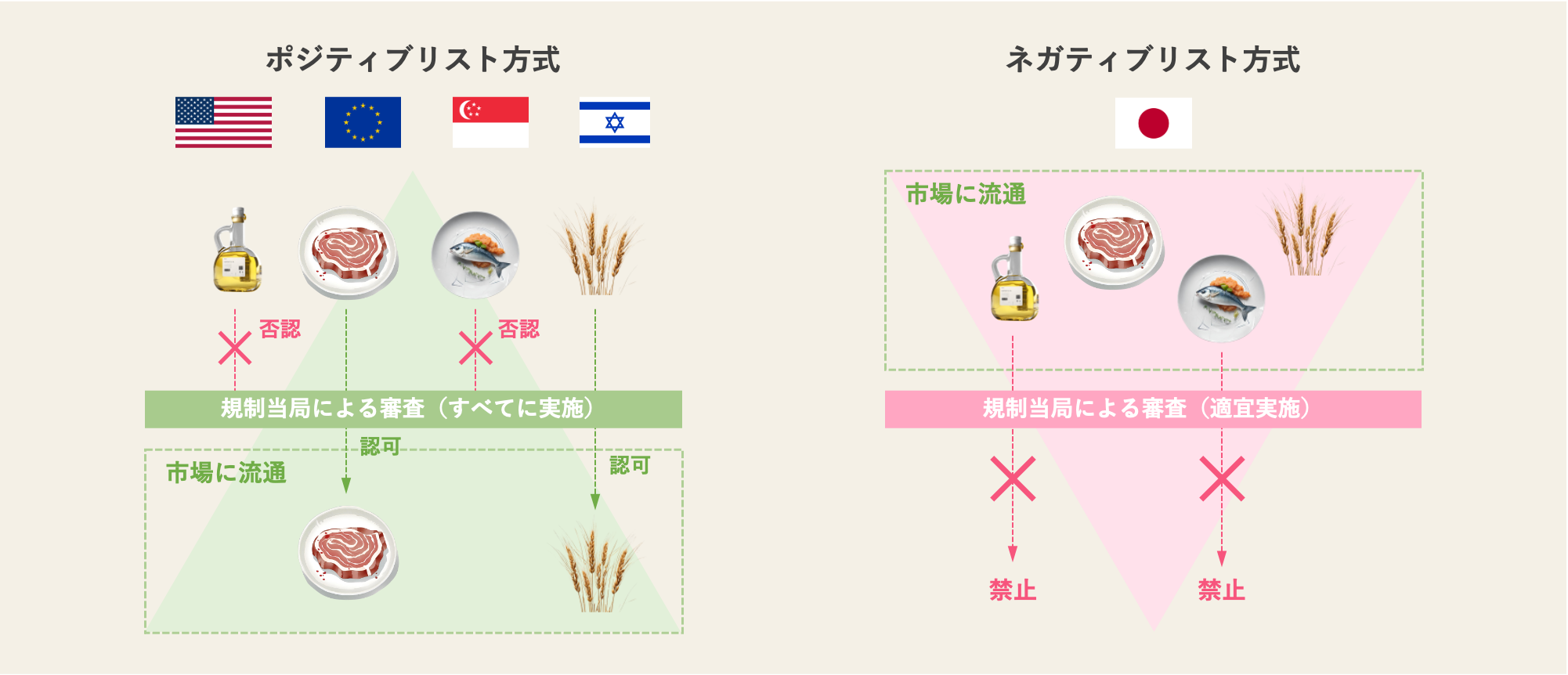
日本における新しい食品の規制については、食品衛生法の第7条で定められています。ここでは詳細は割愛しますが、日本は欧米諸国の多数派と異なり、「ネガティブリスト方式」と呼ばれる手法をとっていることが特徴です。
ネガティブリスト方式とは、新しい食品(=新開発食品)の販売を原則としては認めつつ、個別に規制をかけていくやり方のこと。つまり「新しい食品により健康被害の可能性があると考えられれば、禁止する」ということで、諸外国が採用する「ポジティブリスト方式」とは対極にある考え方となっています。裏を返せば、法律上、日本では新しい食品の販売が「原則自由」に行えるとも解釈できます。
こうしてみると日本では規制のハードルが低く、培養肉の販売もスムーズに行えるように思えますが、何でも自由に販売してよいとなると当然、安全面での問題が生じます。このような懸念から、培養肉については別の規制を設ける可能性も考えられるでしょう。
日本細胞農業協会ウェブサイトのコラムでは、この点について、具体的な内容に触れながら詳しく指摘されています。例えば、同じ食品衛生法の第13条では、「特定の食品や添加物に対して、個別に規格基準を定めることができる」規定があるとのこと。
このルールが実際に適用されているのが、遺伝子組み換え食品です。上記13条に基づいて定められた規格基準の中で、「遺伝子組み換え食品を販売する際は、事前に審査を受けなければならない」ことが一律に規定されています。
培養肉の規制にあたっても、こうした事例を参考に、安全性をチェックする仕組みづくりがなされるのかもしれません。一般社団法人の細胞農業研究機構などが、法規制の枠組み構築に向けて行政とのやり取りなどの活動を行っています。
岸田政権は2023年に入って培養肉の産業育成に乗り出す姿勢を見せており、「安全確保の取り組みや表示ルールの整備など新たな市場を作り出すための環境整備を進め、日本発のフードテックビジネスを育成する」と述べました。
スタートアップ企業の開発努力を社会実装に結び付けるためにも、この先、一般販売を想定した安全基準の制定が進んでいくことが期待されます。
コメント ( 0 )
トラックバックは利用できません。






この記事へのコメントはありません。